| Korean J Health Promot > Volume 20(1); 2020 > Article |
|
žöĒžēĹ
ABSTRACT
Fig. 1.
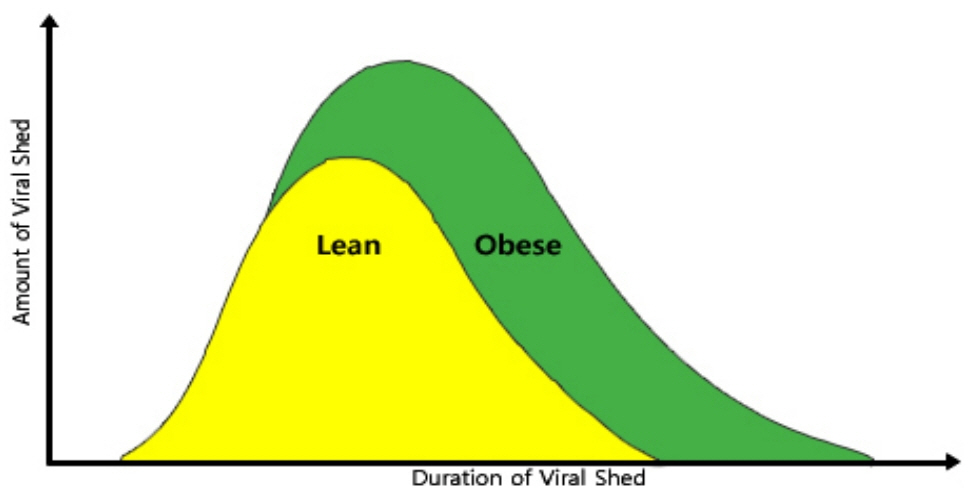
Table 1.
| Pathogen | Subtype | Characteristics | |
|---|---|---|---|
| Adipogenic virus | |||
| ‚ÄÉ | Adenovirus [33] | Human: Ad-5, 9, 31, 36, 37 | Ad-5: childhood obesity |
| Avian: SMAM1 | Ad-36: childhood, adult obesity and BMI | ||
| Phages [21] | Gut phages | Adipogenic gut microbe transfer | |
| Associated human donor | |||
| Herpesvirus [21] | HSV-1, CMV, HHV8 | Increase lipogenesis | |
| Prion (TSEs, slow virus) [17] | Human: KURU | Chronic inflammation | |
| Sheep: scrapie | |||
| Cattle: BSE/CJD | |||
| Other virus [17] | Human: DENV, HIV, HCV | HCV enhance lipid synthesis, insulin resistance | |
| Avian: RAV7 | |||
| Sheep: BDV | DENV: children obesity | ||
| Gut virobiota | Phages, DNA viruses, RNA viruses | Total viral content‚ÜĎ ‚Üí firmicutes‚Üď, bacteriodetes‚ÜĎ [65] | |
| Bacteria | |||
| Chlamydia pneumonia [64] | |||
| Gut microbiota | Bacteroidetes, Firmicutes, Actinobacteria, Proteobacteria | Diversity‚Üď ‚Üí obesity [22] | |
| Bacteroidetes/Firmicutes ratio‚Üď ‚Üí obesity [23] | |||
| Bacteroides‚ÜĎ: high fat diet | |||
| Prevotella‚ÜĎ: high fiber diet | |||
| Ruminococcus‚ÜĎ: high fat diet [66] | |||
| Parasite | |||
| Toxoplasma gondii, Giadia lambria, Blastocytis | |||
| Drug | |||
| Antibiotics | Macrolide | Child (less than 3 years of age) | |
| Antibiotice ‚Üí dysbiosis ‚Üí obesity [16,29-32] | |||
| Helicobacter pylori eradication | Eradication ‚Üí ghrelin‚ÜĎ ‚Üí appetite‚ÜĎ [15] | ||
Abbreviations: ‚ÜĎ, increase ; ‚Üí, affect; ‚Üď, decrease; Ad, adenovirus; BDV, Borna disease virus; BMI, body mass index; BSE, Bovine spongiform encephalopathy; CJD, Creutzfeldt-Jakob disease; CMV, cytomegalovirus; DENV, dengue fever virus; HCV, hepatitis C virus; HHV, human herpesvirus; HIV, human immunodeficiency viruses; HSV-1, herpes simplex virus 1; RAV, Rous-associated virus; SMAM, an avian adenovirus from India; TSEs, transmissible Spongioform Encephalopathies.
Table 2.
| Infection | Key relevance to obesity |
|---|---|
| Children | |
| ‚ÄÉAcute bronchitis | ‚ÜĎ, 5 times in BMI >30 kg/m2 |
| ‚ÄÉAcute bronchiolitis in infants | ‚ÜĎ, odds ratio: 4.67 |
| ‚ÄÉUrinary tract infections | Female: ‚ÜĎ |
| Adults | |
| ‚ÄÉCommunity-acquired infections | ‚ÜĎ |
| ‚ÄÉCommunity-acquired pneumonia | ‚ÜĎ |
| ‚ÄÉNosocomial infections | Pneumonia, Clostridium difficile, Sepsis, Wound infection |
| ‚ÄÉSurgical site infections | ‚ÜĎ |
| ‚ÄÉSepsis | ‚ÜĎ |
| ‚ÄÉInfections risk in the ICU setting [47] | ‚ÜĎ |
| ‚ÄÉH1N1 influenza | Poor prognosis, higher hospitalizations, secondary infections |
| ‚ÄÉPeriodontal infection | ‚ÜĎ, Porphyromonas gingivalis |
| ‚ÄÉRecurrent urinary tract infections | ‚ÜĎ, odds ratio: 4.00 (premenopausal women) |
| ‚ÄÉResponse to antimicrobials | ‚Üď, increased dosage |
| ‚ÄÉResponse to vaccines | ‚Üď (influenza, rabies, hepatitis C vaccine) |
| ‚ÄÉParasite infections | ‚ÜĎ, Chagas disease, Malaria, Leishmaniasis |
REFERENCES
-
METRICS

-
- 1 Crossref
- 0 Scopus
- 1,032 View
- 6 Download
- Related articles
-
The Association between Metabolic Syndrome and Intraocular Pressure2011 June;11(2)
The Association Between Eating Frequency and Metabolic Syndrome2011 March;11(1)
Association between Serum Carotenoids and Metabolic syndrome2009 December;9(4)
Association between Metabolic Syndrome and Depression in Community-dwelling Adults2009 December;9(4)




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print